Introdução
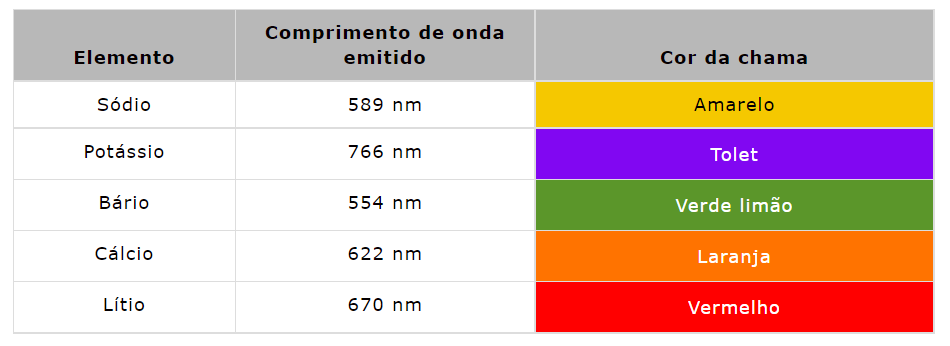
Durante a década de 1980, Bowling Barnes, David Richardson, John Berry e Robert Hood desenvolveram um instrumento para medir as baixas concentrações de sódio e potássio em uma solução. Eles nomearam este instrumento como fotômetro de chama. O princípio do fotômetro de chama baseia-se na medição da intensidade da luz emitida quando um metal é introduzido na chama. O comprimento de onda da cor fornece informações sobre o elemento e a cor da chama fornece informações sobre a quantidade do elemento presente na amostra.
A fotometria de chama é um dos ramos da espectroscopia de absorção atômica. Também é conhecida como espectroscopia de emissão de chama. Atualmente, tornou-se uma ferramenta necessária no campo da química analítica. Fotômetro de chama pode ser usado para determinar a concentração de certos íons metálicos como sódio, potássio, lítio, cálcio e césio etc. Nos espectros de fotômetro de chama os íons metálicos são usados na forma de átomos. O Comitê de Nomenclatura Espectroscópica da União Internacional de Química Pura e Aplicada (IUPAC) nomeou essa técnica como espectrometria de emissão atômica de chama (FAES).
Princípio do fotômetro de chama
Os compostos dos metais alcalinos e alcalino-terrosos (Grupo II) dissociam-se em átomos quando introduzidos na chama. Alguns desses átomos ficam ainda mais excitados para níveis ainda mais altos. Mas esses átomos não são estáveis em níveis mais altos.
Assim, esses átomos emitem radiações ao retornar ao estado fundamental. Essas radiações geralmente estão na região visível do espectro. Cada um dos metais alcalinos e alcalino-terrosos tem um comprimento de onda específico.
Para certas faixas de concentração,
A intensidade da emissão é diretamente proporcional ao número de átomos que retornam ao estado fundamental. E a luz emitida é por sua vez proporcional à concentração da amostra.
Partes do fotômetro de chama
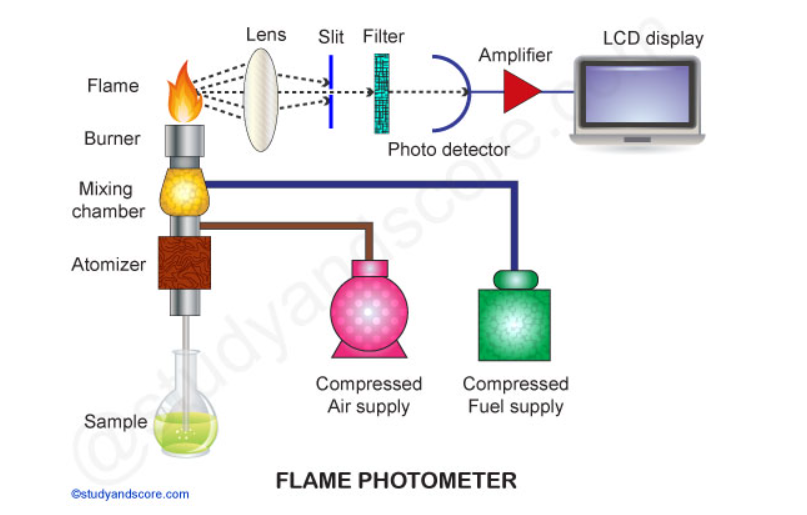
Um fotômetro de chama simples consiste nos seguintes componentes básicos:
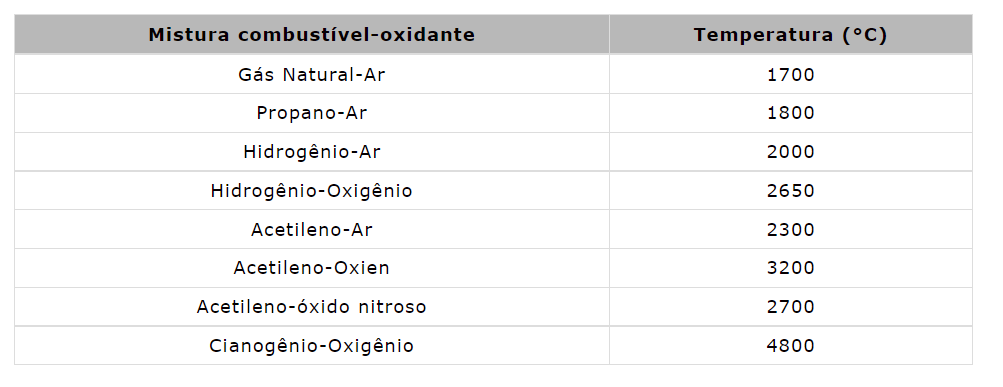
Fonte de chama: Um queimador no fotômetro de chama é a fonte de chama. Pode ser mantido em temperatura constante. A temperatura da chama é um dos fatores críticos na fotometria de chama.
Nebulizador: O nebulizador é usado para enviar solução homogênea para a chama a uma taxa equilibrada.
Sistema óptico: O sistema óptico consiste em espelho convexo e lente convexa. O espelho convexo transmite a luz emitida pelos átomos. O espelho convexo também ajuda a focar as emissões para a lente. A lente ajuda a focar a luz em um ponto ou fenda.
Filtros de cores simples: Os reflexos do espelho passam pela fenda e chegam aos filtros. Os filtros isolarão o comprimento de onda a ser medido das emissões irrelevantes.
Fotodetector: A intensidade da radiação emitida pela chama é medida pelo fotodetector. Aqui a radiação emitida é convertida em um sinal elétrico com a ajuda do fotodetector. Esses sinais elétricos são diretamente proporcionais à intensidade da luz.
Procedimento de trabalho
- Tanto a solução padrão quanto a solução amostra são preparadas em água destilada fresca.
- A chama do fotômetro é calibrada ajustando o ar e o gás. Depois deixa-se a chama estabilizar durante cerca de 5 min.
- Agora o instrumento está ligado e as tampas da câmara do filtro são abertas para inserir os filtros de cor apropriados.
- As leituras do galvanômetro são ajustadas para zero pulverizando água destilada na chama.
- A sensibilidade é ajustada pulverizando a solução de trabalho padrão mais concentrada na chama. Agora a deflexão de escala total do galvanômetro é registrada.
- Novamente água destilada é pulverizada na chama para obter leituras constantes do galvanômetro. Em seguida, o galvanômetro é reajustado para zero.
- Agora, cada uma das soluções de trabalho padrão é pulverizada na chama por três vezes e as leituras do galvanômetro são registradas. Após cada pulverização, o aparelho deve ser cuidadosamente lavado.
- Finalmente, a solução de amostra é pulverizada na chama por três vezes e as leituras do galvanômetro são registradas. Após cada pulverização, o aparelho deve ser cuidadosamente lavado.
- Calcule a média da leitura do galvanômetro.
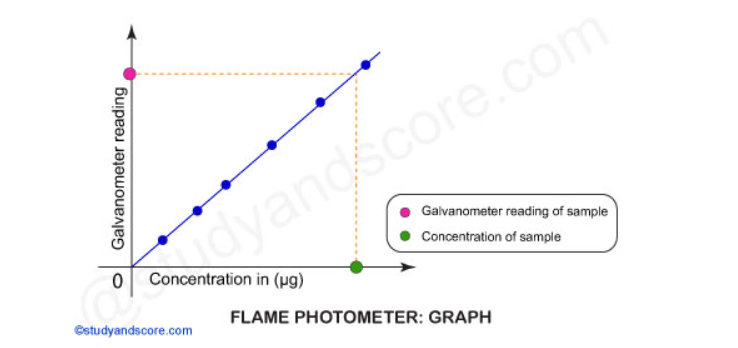
- Trace o gráfico de concentração contra a leitura do galvanômetro para descobrir a concentração do elemento na amostra.

- O solvente é primeiro aspirado para obter partículas sólidas finas.
- Essas moléculas nas partículas sólidas são movidas em direção à chama para produzir átomos e íons gasosos.
- Esses íons absorvem a energia da chama e são excitados para altos níveis de energia a partir do estado fundamental.
- Mas como esses íons são instáveis, eles retornam ao estado fundamental. Ao retornar, eles emitem radiação característica.
- A intensidade da luz emitida é proporcional à concentração do elemento.
Os oxidantes no fotômetro de chama são principalmente ar, oxigênio ou óxido nitroso. A temperatura da chama depende da proporção de combustível e oxidante.
Os processos que ocorrem durante a análise do fotômetro de chama estão resumidos abaixo:
Dessolvatação: A dessolvatação envolve a secagem de uma amostra em uma solução. As partículas de metal no solvente são desidratadas pela chama e assim o solvente é evaporado.
Vaporização: As partículas de metal na amostra também são desidratadas. Isso também levou à evaporação do solvente.
Atomização: A atomização é a separação de todos os átomos em uma substância química. Os íons metálicos na amostra são reduzidos a átomos de metal pela chama.
Excitação: A força eletrostática de atração entre os elétrons e o núcleo do átomo os ajuda a absorver uma determinada quantidade de energia. Os átomos então saltam para o estado de energia mais alto quando excitados.
Emissão: Como o estado de energia mais alto é instável, os átomos voltam ao estado fundamental ou estado de baixa energia para ganhar estabilidade. Este salto de átomos emite radiação com comprimento de onda característico. A radiação é medida pelo fotodetector.
A equação de Scheibe-Lomakin descreve a intensidade da luz emitida com a ajuda da seguinte fórmula:
I = k × c n
Onde:
I = Intensidade da luz emitida
c = Concentração do elemento
k = Constante de proporcionalidade
Na parte linear da curva de calibração n~1,
então I = k × c. Em outras palavras, a intensidade da luz emitida está diretamente relacionada à concentração da amostra.

Aplicações do fotômetro de chama
- O fotômetro de chama pode ser aplicado tanto para análise quantitativa quanto qualitativa de elementos. As radiações emitidas pelo fotômetro de chama são características de um determinado metal. Assim, com a ajuda do fotômetro de chama, podemos detectar a presença de qualquer elemento específico na amostra dada.
- A presença de alguns elementos do grupo II é fundamental para a saúde do solo. Podemos determinar a presença de vários metais alcalinos e alcalino-terrosos na amostra de solo realizando o teste de chama e, em seguida, o solo pode ser fornecido com fertilizante específico.
- As concentrações de íons Na+ e K+ são muito importantes no corpo humano para a realização de várias funções metabólicas. Suas concentrações podem ser determinadas diluindo e aspirando a amostra de soro sanguíneo para a chama.
- Refrigerantes, sucos de frutas e bebidas alcoólicas também podem ser analisados usando fotometria de chama para determinar as concentrações de vários metais e elementos.
Vantagens do fotômetro de chama
- O método de análise é muito simples e econômico.
- É uma análise rápida, conveniente, seletiva e sensível.
- É de natureza qualitativa e quantitativa.
- Mesmo concentrações muito baixas (partes por milhão/ppm a partes por bilhão/intervalo de ppb) de metais na amostra podem ser determinadas.
- Este método compensa qualquer material interferente inesperado presente na solução de amostra.
- Este método pode ser usado para estimar elementos que raramente são analisados.
Desvantagens do fotômetro de chama
- Apesar de muitas vantagens, esta técnica de análise tem algumas desvantagens:
- A concentração exata do íon metálico na solução não pode ser medida.
- Ele não pode detectar e determinar diretamente a presença de gases inertes.
- Embora esta técnica meça o teor total de metal presente na amostra, ela não fornece informações sobre a estrutura molecular do metal presente na amostra.
- Apenas amostras líquidas podem ser usadas. Também a preparação da amostra torna-se demorada em alguns casos.
- A fotometria de chama não pode ser usada para a determinação direta de cada átomo de metal. Um número de átomos de metal não pode ser analisado por este método. Os elementos como carbono, hidrogênio e haletos não podem ser detectados devido à sua natureza não radiante.